アオコの毒素
アオコの毒の生産と構造
ラン藻は光合成を行うという点においては植物であり、藻類の仲間であるが、その細胞の成り立ちからみると、核、葉緑体、ミトコンドリア等の器官を含んでおらず、細菌と同様に原核生物の範疇にはいる。ラン藻は大気中に酸素を供給して現在の地球環境を作り上げた重要な生物であり、化石によると35億年前にはすでに地球上に存在していたと考えられている。このようにラン藻は生命の歴史を探る上で極めて興味深いものであるが、前述のように最近このラン藻が人間にとって脅威の存在となりつつある。
有毒ラン藻による被害の報告は1878年まで遡り、オーストラリアのアレキサンドリア湖に発生した有毒ラン藻による家畜の死亡をG. フランシスがNature誌に発表したのが最初である。その後1930年代から1940年代にかけて、カナダ、アメリカ、オーストラリア、南アフリカを中心に牛、馬、羊等の家畜や、アヒル、ガチョウ等の水鳥、キジ、野うさぎ等の野生動物の被害が数多く報告された。日本における有毒ラン藻に関する最初の報告は、1980年東京都立衛生研究所の渡辺らによりなされた。 家畜動物等の斃死の原因種として多くの事例が報告され、また毒素の化学構造等が詳しく研究されているラン藻類は、Anabaena、 Aphanizomenon、Microcystis、 Oscillatoria、 Nostoc、 Nodularia、Cylindrospermopsis、Umezakiaである。表1は生産する毒素とその毒性を併せて示したもので、前2者は主として神経毒を、後7者は主に肝臓毒を生産する(図1)。

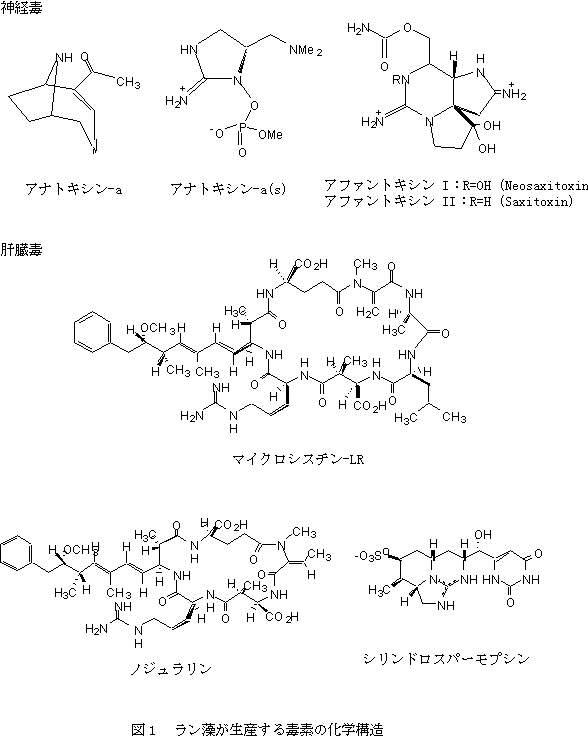
このうち、世界各地で最も普遍的に見られるラン藻はMicrocystis属で、毒素の構造研究もMicrocystis属の単藻培養の成功を機に本格的に始まった。有毒M. aeruginosa株を用いて1959年、C. T. ビショップらはアスパラギン酸、グルタミン酸など7種類のアミノ酸からなり、そのLD50値は0.5mg/kgである環状ペプチドを単離した。その後、1965年にH. コンストらは、Microcystisからの肝臓毒をマイクロシスチン(microcystin)と命名した。そして、この化合物の構造は1984年南アフリカのD. P. ボーツらによって初めて明らかにされた。彼らはこの毒素をシアノジノシン(cyanoginosin)と命名したが、W. W. カーマイケルらの提唱により、本化合物に対して最初に用いられたマイクロシスチンの名称が使われている。
G. フランシスが動物に被害を与えた有毒ラン藻として最初に報告したNodularia spumigenaは、汽水中に育つラン藻で、マイクロシスチンと同様に肝毒性を有するノジュラリン(nodularin)を産生する。この化合物の構造決定は1988年K. L. ラインハートらによって行なわれ、異常アミノ酸であるAddaとデヒドロアミノ酸を含む5種のアミノ酸から成る環状ペプチドであることが明かとなった(図1)。
1979年オーストラリアのパーム島で、ラン藻が大量に発生した貯水池の水を飲んだ150あまりの人が肝臓障害を起こした。この時貯水池は硫酸銅による処理が行われており、ラン藻から何らかの有毒化合物が放出されたものと考えられた。その後の調査の結果、Cylindrospermopsis rachiborskiiが原因種であることが判明した。1992年になりハワイ大学のR. E. ムーアらは肝臓毒性を示すシリンドロスパーモプシン(cylindrospermopsin)を単離した。この化合物はグアニジンを含む三環性部分にウラシルが結合した構造を有していた(図1)。ごく最近になって福井県の三方湖で採取されたラン藻、Umezakia natansからもシリンドロスパーモプシンが単離された。
Anabaena flos-aquaeの毒素はアナトキシン(anatoxin)と名付けられ、有毒な株はP. R. ゴーハムらにより最初に分離されたが、マウスに対する作用が異なることより初め6種類の毒素の存在が予測された。構造が決められたのはそのうちのアナトキシン -a, -a(s)、-cの3種類である。アナトキシン aは分子量165の2級アミン2-acetyl-9-azabicyclo[4,2,1]non-eneとして淡水産ラン藻の中で最初に構造決定された毒素であり、LD50は約200μg/kg(マウス、腹腔内)である。化学構造はコカインに似ており、コカインの環状構造を利用した合成も報告されている(図1)。アナトキシン aは神経伝達物質であるアセチルコリンに似た挙動を示し、自律神経節及び骨格筋の神経筋接合部の後シナプス膜アセチルコリン受容体に結合、持続性脱分極を起こして伝達を遮断する。症状として、歩行異常、筋肉の麻痺、痙攣などがあらわれ、呼吸不全で4?5分で死亡する。特に鳥類は反弓緊張といわれる頭部を後ろにそらす症状を見せる。
アナトキシン aはアセチルコリンの疑似化合物として研究用試薬となっている。アナトキシン aはアセチルコリンエステラーゼにより分解されないので、アナトキシン aおよびその誘導体はアセチルコリン受容体との結合の仕方や、受容体活性への影響を調べるための代替化合物として用いることができる。また、アナトキシン aの誘導体を用いてアルツハイマー病の神経衰退を遅らせようという研究も始められている。この病気の患者の多くはアセチルコリンを合成するニューロンが破壊されている.アセチルコリン自身はすぐに消失してしまうので,消失した神経伝達物質を補うために投与することはできないが,毒性を軽減した構造に修飾したアナトキシン aはその用途に用いることができるであろう.また、誘導体は重症筋無力症のように,アセチルコリンが欠乏したり,あるいはアセチルコリンの正常な働きが妨げられた疾患等に対して有効であるかもしれない.
アナトキシン a (s)(anatoxin a (s))もAnabaena flos-aquaeから分離されているが、アナトキシン aを作るものとは別の株である。この毒素はアナトキシン aと同様の作用を示すことが多いので類似した名称が付けられた。また脊椎動物に多量のよだれを分泌させる(英語でsalivate)作用があることから"s"が付け加えられた。この毒素の構造はなかなか明かにならなかったが、最近になって環状ヒドロキシグアニジンにメチル化されたリン酸がエステル結合した分子量252の物質であることが明らかにされた(図1)。アナトキシン a (s)とアナトキシン aは化学的に異なる化合物であり、その毒性発現機構も異なることが明らかとなっている。すなわち、アナトキシン aがアセチルコリン受容体に結合するのに対して、アナトキシン a (s)はアセチルコリンエステラーゼがアセチルコリンを分解することを妨害するのである。アナトキシン a (s)は天然有機リン化合物であり。パラチオンやマラチオンといった合成有機リン系殺虫剤と極めて類似した作用を示す。アナトキシン a (s)は合成有機リン系殺虫剤よりも水に可溶性で、それゆえ生物分解されやすく、殺虫剤としてより安全であると思われる。なお、アナトキシン cはマイクロシスチンのデスメチル体であることが明かとなっている。
Aphanizomenonに含まれる毒素による被害はアメリカ合衆国北部、カナダの南部地域と限られた地域で見られている。この毒素による魚の大量へい死が北米ニューハンプシャー州の湖で1960年代に起きて以来、毒素の化学的諸性質や実験動物に対する影響が麻痺性貝毒と似ていることが指摘されていた。M. アラムらはApha. flos-aquaeから単離した毒素をTLCや呈色反応の違いから麻痺性貝毒であるサキシトキシン(saxitoxin)とは異なるものとしたが、再び単離を試みた結果、サキシトキシンのほかに3種類の毒素を精製した。その後、サキシトキシンとネオサキシトキシン(neosaxitoxin)がApha. flos-aquaeから同定された(図6)。Aphanizomenonの毒素はこれら同定された2成分のほかに2〜3の有毒成分のあることが報告されてはいるが化学的には明かとなっていない。 海産と陸水産という生息域が異なり、また、分類学的にもかけ離れた種類がなぜ同じ毒素を産生するのかということは極めて興味深い問題である。
