マイクロシスチン
マイクロシスチンの化学構造
マイクロシスチンは、D-アラニン(D-Ala)、D-グルタミン酸(D-Glu)、エリスロ-b-メチル-D-アスパラギン酸(D-MeAsp)、デヒドロアミノ酸であるN-メチルデヒドロアラニン(Mdha)および炭素原子20個から成るβ-アミノ酸、3-アミノ-9-メトキシ-10-フェニル-2,6,8-トリメチル-4,6-デカジエン酸(Adda)の5種類の構成アミノ酸を共通骨格としてもち、さらに成分によって変化する2種のL-アミノ酸(R1, R2)の、計7種のアミノ酸から成る環状ペプチドである(図1)。マイクロシスチンは成分によって変化する2種のL-アミノ酸の一文字表示法を用いて、例えばそれらがロイシン(Leu)とアルギニン(Arg)であればマイクロシスチン LRと呼ばれる。マイクロシスチンの構造の違いは主に2種のL-アミノ酸の変化によるが、図1に示すように部分的に構造が修飾されたものなど現在までに約60種の成分が報告されている。
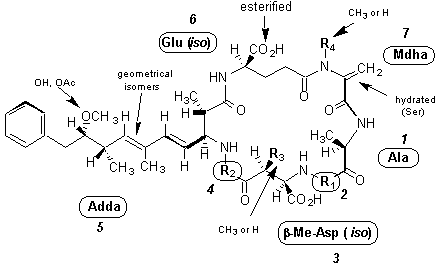
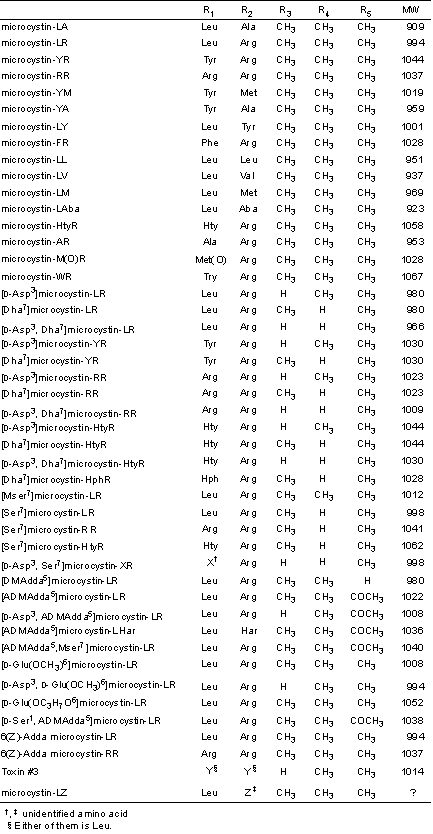
図1
マイクロシスチンの生理作用
単離、精製したマイクロシスチンをマウスの腹腔内に投与した時のLD50値は70〜600 μg/kgである。毒性は海洋天然毒であるテトロドトキシンやサキシトキシンより弱いものの、青酸カリよりはるかに強力である。現在までに、40を超えるマイクロシスチンの同族体や誘導体が単離、報告されており、構造と毒性(腹腔内投与)の関係が明かになりつつある。まず、R1 や R2 のL-アミノ酸の違いにより3つのグループに分類される。LRやLAがきわめて強い毒性(50-100 μg/kg)を、YRやWRが中程度の毒性(100-400 μg/kg)を示すのに対し、RRやM(O)Rではかなりその毒性が減少する(400-800 μg/kg)。Mdhaやb-Me-Asp における"デスメチル"体(R3やR4)ではいずれも中程度の毒性を示す。Adda部分は生理活性に深く関与しているとされており、メトキシ基がアセチル基や水酸基に代わった誘導体の毒性はほとんど変わらないが、6、7位の二重結合が異性化した誘導体(6 (Z)-Adda)はほとんど毒性を示さない。また、オゾン酸化でベンゼンを含む部分を開裂させた生成物も無毒である。さらに、興味深いことは2個の遊離のカルボキシル基のうちのGluのそれをエステル化すると毒性が完全に消失する。しかし、Mdhaの二重結合を還元あるいはグルタチオンなどを付加させてもその毒性は半分に減少する程度である。
マイクロシスチンを投与されたマウスは麻痺や四肢の先の貧血、呼吸障害などを起こし、1時間程で死亡する。直接の死因は出血性ショックと肝機能不全であり、肝臓が赤黒くうっ血し約1.5倍に肥大する。また、一部の類洞内皮細胞が破壊され、肝小葉の壊死が認められるが、他の臓器への影響はほとんど見られない。マイクロシスチンの肝臓への特異性は体内動態の面でも際だっている。生体内分布に関しては標識体を用いた研究がいくつか報告されているが、それによれば腹腔内投与されたマイクロシスチンの大部分は直ちに肝臓に取り込まれ、1週間ほどそこに滞留するといわれる。
マイクロシスチンは、生体内標的分子としてタンパク質脱リン酸化酵素プロテインフォスファターゼ1及び2Aが明らかにされており、いわゆるオカダ酸クラス化合物の一つである。マウスの阻害肝細胞質の精製酵素に対する阻害活性はオカダ酸に匹敵する。阻害様式はオカダ酸で非競合型ないし混合型と推定されており、マイクロシスチンでも同様の可能性がある。オカダ酸で見いだされた多くの細胞への作用、例えば肝細胞や繊維芽細胞の形態変化がマイクロシスチンによって惹起されているが、肝細胞以外の細胞へは取り込まれにくいようである。また、クロイソ海綿由来のオカダ酸、チョコガタイシ海綿由来のカリキュリン Aなどオカダ酸クラス化合物は強力な肝臓癌促進物質(プロモーター)として知られている。受容体が同じであることからマイクロシスチンについても同様の結果が予想されたが、ジエチルニトロソアミンをイニシエーターとし、マイクロシスチン LRを腹腔内投与した実験などから証明された。
ところで、発癌プロモーターとしては、TPAクラス化合物がよく知られている。TPA(12-O-tetradecanoylphorbol-13-acetate、起源はトウダイグサ科のCroton tiglium L.の種子)、テレオサイジン(起源は放線菌Streptomyces mediocidicus及び海産ラン藻Lyngbya majescula)などは、細胞内のタンパク質リン酸化酵素プロテインキナーゼ Cを特異的受容体としている。プロテインキナーゼCはATPをリン酸基の供与体としてタンパク質のセリンないしスレオニン残基にリン酸化を行うことによって、細胞内の情報伝達機構に中心的役割を果たしている分子の一つで、この酵素の異常(異常な活性化も含めて)は様々な細胞機能の乱れとして現われてくる。細胞の癌化もその顕著なものと考えられる。これに対して、オカダ酸クラス化合物の受容体プロテインフォスファターゼ1及び2Aはタンパク質のセリンないしスレオニン残基に結合したリン酸基を特異的に切ることが知られ、この酵素の阻害によってリン酸化の促進と同じ結果をもたらすという点が特に興味深い。プロモーションの過程にどのタンパク質のリン酸化、あるいはリン酸化タンパク質の蓄積が重要な役割を担うのか解明が待たれる。
以上は、精製マイクロシスチンを用いた研究から見いだされた結果であるが、ラン藻自身あるいはラン藻の粗抽出物を用いた実験ではより多様で強い生理作用が観察されることが知られており、マイクロシスチン以外の物質の関与が考えられている。最近、マイクロシスチン以外のペプチドの単離が報告され、いずれも酵素阻害活性を有するといわれるが、マイクロシスチンとの共存の場合の生理活性などの検討は今後の検討課題である。また、肝毒性の発現メカニズムについても脱リン酸化酵素を阻害だけでは説明することができず、脱リン酸化の阻害から細胞傷害に至る分子レベルでのメカニズムの解明が必要であり、発癌プロモーションについても同様である。リン酸化される基質タンパクの同定とその機能の解明、ラン藻由来の物質だけでなく、毒性の発現過程で共同して働く、生体中に存在するあるいは産生される物質の解明が必要である。
